Weltweit gibt es Tausende Wissenschafter_innen, die sich mit Katalyse befassen und zu einer sauberen und effizienten Nutzung von Ressourcen beitragen wollen. Ziel ist es, nachhaltigere und energieeffizientere Wege zur Herstellung hochwertiger Produkte durch Verwertung oft ungeliebter (Abfall-)Stoffe zu entwickeln.

Text: Jakob Rath
Mit BioInspiration zu grüner Katalyse
Mi 28. Juni 2023
Wie läuft dieser chemische Prozess ab?
Als Katalysatoren bezeichnet man chemische Verbindungen, die bestimmte Reaktionen beschleunigen, ohne dabei selbst verbraucht zu werden. Dieser Prozess heißt katalytische Reaktion. Der Katalysator wirkt stabilisierend auf den sogenannten aktivierten Komplex, einen äußerst kurzlebigen Zustand, der im Verlauf der Reaktion den Punkt höchster intrinsischer – also dem System innewohnender – Energie darstellt. In der Natur strebt jedes Teilchen einem Prozess minimalster Energie zu, dies erklärt auch die Kurzlebigkeit des Übergangszustandes. Die Höhe der Energiebarriere dieses Zustandes ist charakteristisch für die Wahrscheinlichkeit, dass ein Prozess bei einer bestimmten Bedingung (Temperatur, Druck, Konzentration) abläuft. Durch seine stabilisierende Wirkung verringert der Katalysator die Energiebarriere – die nötige Aktivierungsenergie wird also kleiner. So wird die Reaktion unter Bedingungen möglich, die normalerweise nicht für die Überwindung der Barriere geeignet sind. Der Vorgang wird hier veranschaulicht:
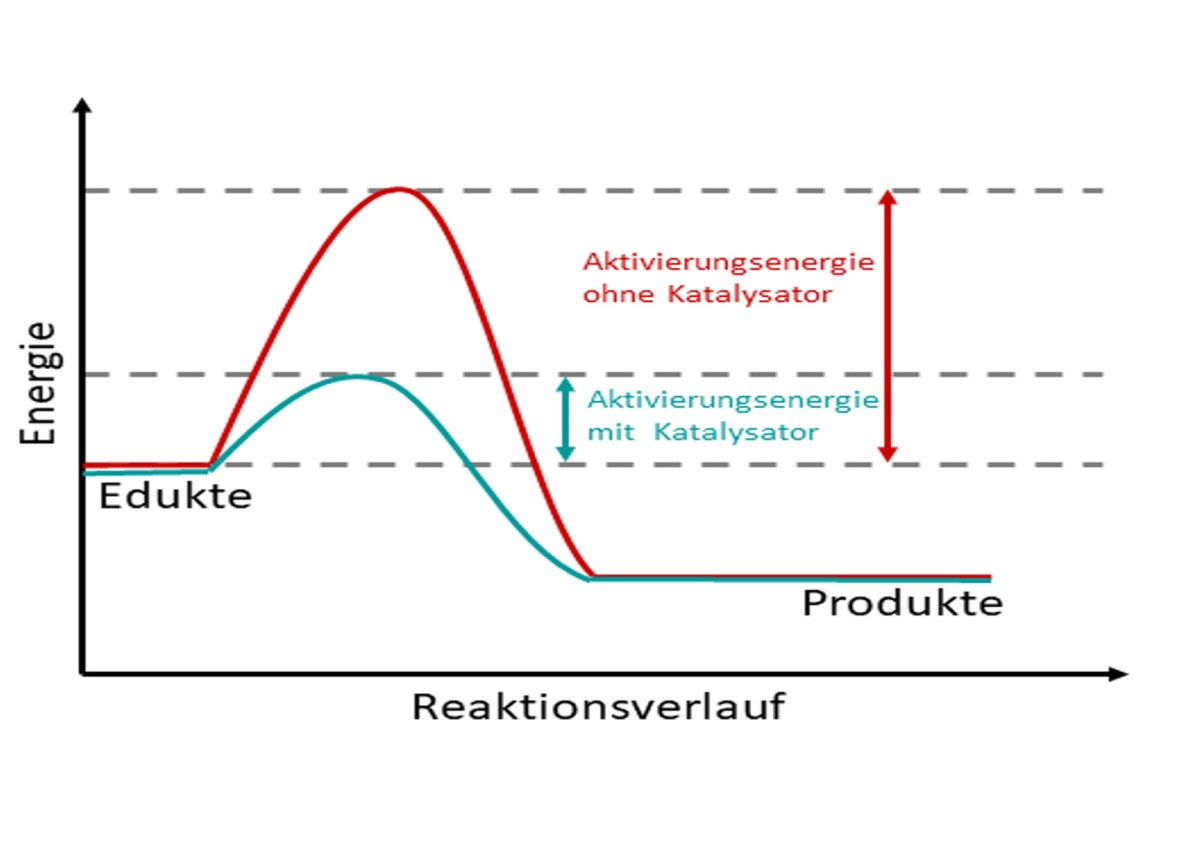
Grafische Erläuterung der katalytischen Herabsetzung der Aktivierungsenergie – die absoluten Werte der Energien von Edukten, also Ausgangsstoffen, und Produkten unterscheiden sich nicht, sondern es nimmt ausschließlich die Höhe der Barriere dazwischen ab
© serlo.org/katalysator
Abhängig davon, ob der verwendete Katalysator in derselben Phase, also demselben Aggregatzustand, vorliegt wie die Ausgangsstoffe (Edukte) und Produkte, unterscheiden wir zwischen homogener (einphasiger) und heterogener (mehrphasiger) Katalyse.
Homogene Katalyse in gelöster Form wirkt bei vielen säure- oder basekatalysierten Prozessen in wässriger Lösung, zum Beispiel die Verseifung tierischer und pflanzlicher Fettsäuren (Triglyceride) zur Herstellung von Seifen.
Ein Beispiel für heterogene Katalyse finden wir im Abgaskatalysator, wo das bei der Verbrennung entstehende Schadgas (CO, NOx) beim Durchfluss durch das feinporige Katalysatormaterial in weniger schädliche Gase umgewandelt wird.
In lebenden Organismen spielen beide Formen eine große Rolle, sie treten aber meist gemischt auf. In biologischen Systemen (so auch im menschlichen Stoffwechsel) kennen wir diese Katalysatoren unter dem Namen „Enzyme“. Das sind spezielle Proteine (Biopolymere auf Basis von Aminosäuren), die im Stoffkreislauf unterschiedlichste Aufgaben übernehmen – vom Aufbau komplexer Strukturen aus simplen Ausgangsstoffen bis zum Abbau von Giftstoffen. Ein Beispiel ist der Alkoholabbau durch die Alkoholdehydrogenase (ADH); der dabei entstehende Acetaldehyd beschert uns den „Kater“ nach Alkoholgenuss. Die Enzyme ermöglichen erst den Ablauf einzelner Prozesse oder ganzer Kaskaden unterschiedlicher Vorgänge.
Im katalytischen Prozess der Fotosynthese wandeln etwa Pflanzen mithilfe von Lichtenergie die simplen Moleküle Wasser und Kohlenstoffdioxid in Zucker und Sauerstoff um. Dieser Vorgang, der in der folgenden Grafik skizziert ist, bildet die Grundlage für die Existenz aller höheren Lebensformen, auch von uns Menschen, und fasziniert Forscher_innen seit vielen Jahrhunderten.
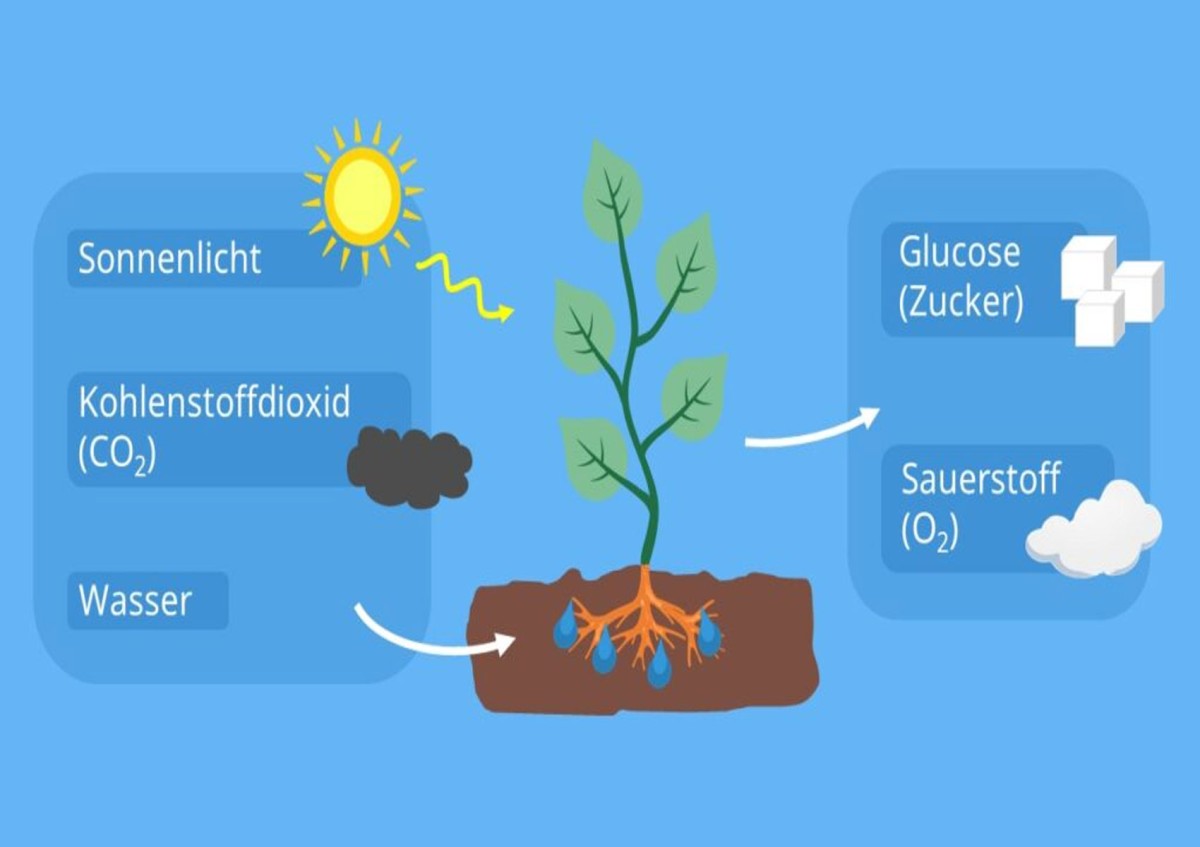
Schematische Darstellung der Fotosynthese – mithilfe von Sonnenenergie wandelt die Pflanze in ihren Chloroplasten die simplen Moleküle Wasser und Kohlenstoffdioxid in Sauerstoff und komplexe Zuckermoleküle um und schafft damit die Grundlage höheren Lebens
© studifix.de/biologie/photosynthese
Die genauen Mechanismen dieses „wichtigsten“ Vorgangs der Welt konnten erst im Laufe des letzten Jahrhunderts schrittweise geklärt werden. Was jedoch bald klar wurde, ist die Tatsache, dass vor allem die heterogene Katalyse stark von der Oberfläche des Materials abhängt, weshalb heute häufig versucht wird, durch eine Maximierung der Oberfläche die katalytische Aktivität eines bestimmten Materials zu erhöhen. Denn je mehr Oberfläche das Material hat, desto mehr Moleküle können an dieser binden und dort weiter-reagieren. Aus dieser Fragestellung hat sich der Forschungsbereich rund um Nano-Materialien entwickelt, ein Zusammenhang, der in den folgenden elektronenmikroskopischen Bildern erkennbar ist.
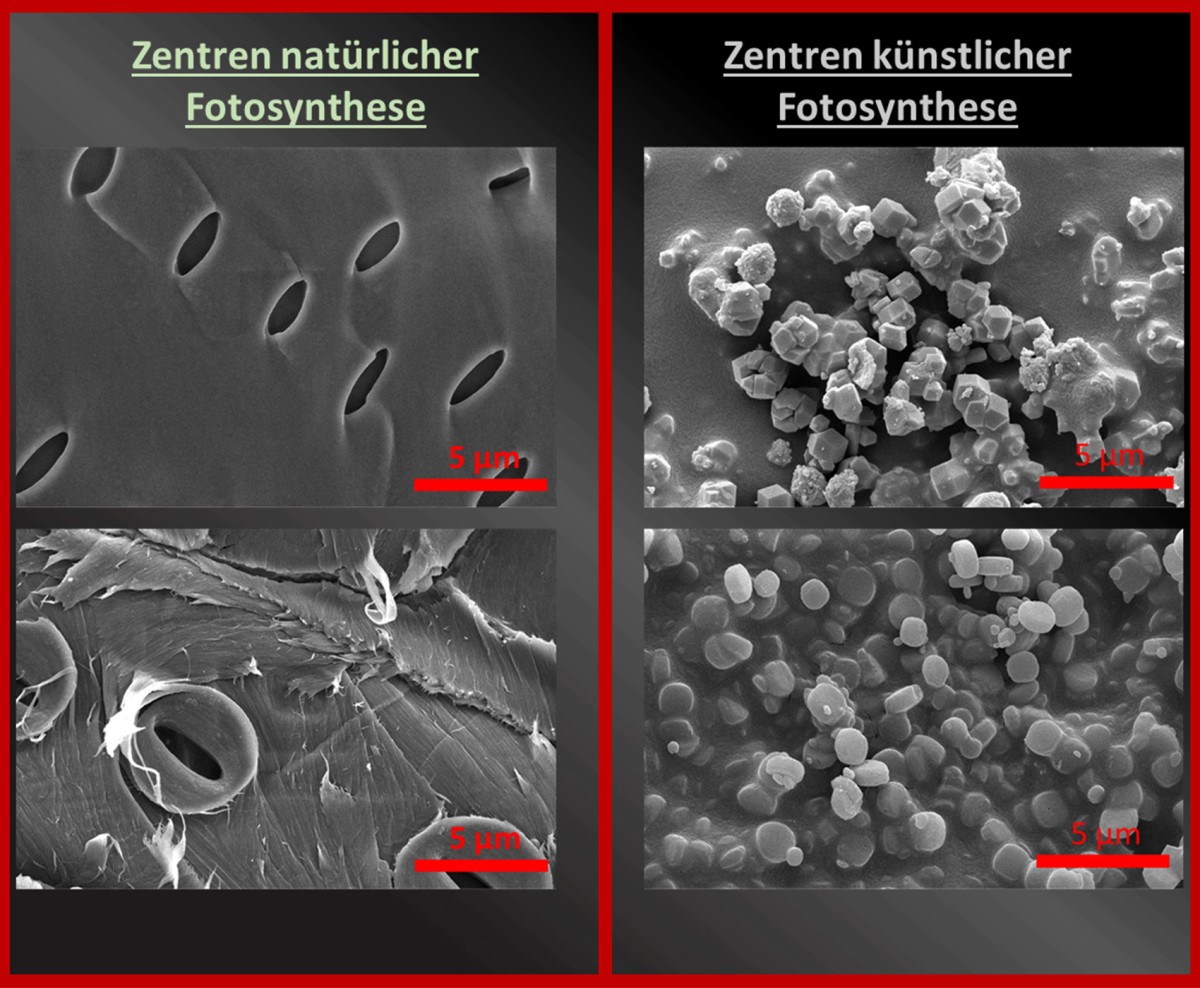
Rasterelektronenmikroskopische Aufnahmen von Zentren der natürlichen und künstlichen Katalyse: A – Spaltöffnungen zweier unterschiedlicher heimischen Pflanzen, durch die das für die Fotosynthese nötige Gasgemisch in die Pflanze strömt; B – Unterschiedliche künstlich geschaffene Nanopartikel mit katalytischen Eigenschaften für die fotochemische Wasserspaltung; die offensichtlichste Gemeinsamkeit dieser Aufnahmen besteht in der ähnlichen Größe der funktionsgebenden Komponenten; Vergrößerung 20.000-fach
© Jakob Rath, TU Wien
Die Wissenschaft versucht der Fotosynthese ähnliche Prozesse mit künstlichen Katalysatoren nachzuahmen, zu adaptieren und zu optimieren.
So ist der industriell bedeutendste Prozess unserer Zeit das Haber-Bosch-Verfahren, ein Paradebeispiel für die Erforschung und Entwicklung von höchst effizienten Katalysatoren. Mithilfe eisenoxidhaltiger Katalysatoren wird Stickstoff (N2) aus der Luft unter hohem Druck (250–350 bar) und hoher Temperatur (450–550 °C) mit Wasserstoffgas (H2) vermengt. Dabei bildet sich Ammoniak (NH3), die Basis für die globale Düngemittelproduktion. Ohne diesen Prozess wäre Europa Anfang des 20. Jahrhunderts in eine Hungersnot geglitten, da natürliche Stickstoffverbindungen wie Vogeldung (Guano) nicht in ausreichender Menge vorhanden waren, um den steigenden Bedarf zu decken. Die Ammoniakproduktion ist übrigens für 1,1 % des weltweiten Energieverbrauchs verantwortlich – es gibt kein anderes einzelnes technisches Verfahren mit einem solchen industriellen Stellenwert. Seit seiner Entwicklung um 1904 wurden insgesamt drei Nobelpreise für dieses Verfahren verliehen, ein weiteres Indiz für seine massive Bedeutung.
Auch das Institut für Materialchemie der Technischen Universität Wien arbeitet mit Hochdruck an der Entwicklung moderner Katalysatoren, etwa für die fotokatalytische Wasserspaltung – eine ebenfalls durch (Sonnen-)Licht ausgelöste chemische Reaktion. Damit möchte man Wasserstoff, einen nachhaltigen Universalbrennstoff, mittels Sonnenlicht direkt aus Wasser gewinnen.
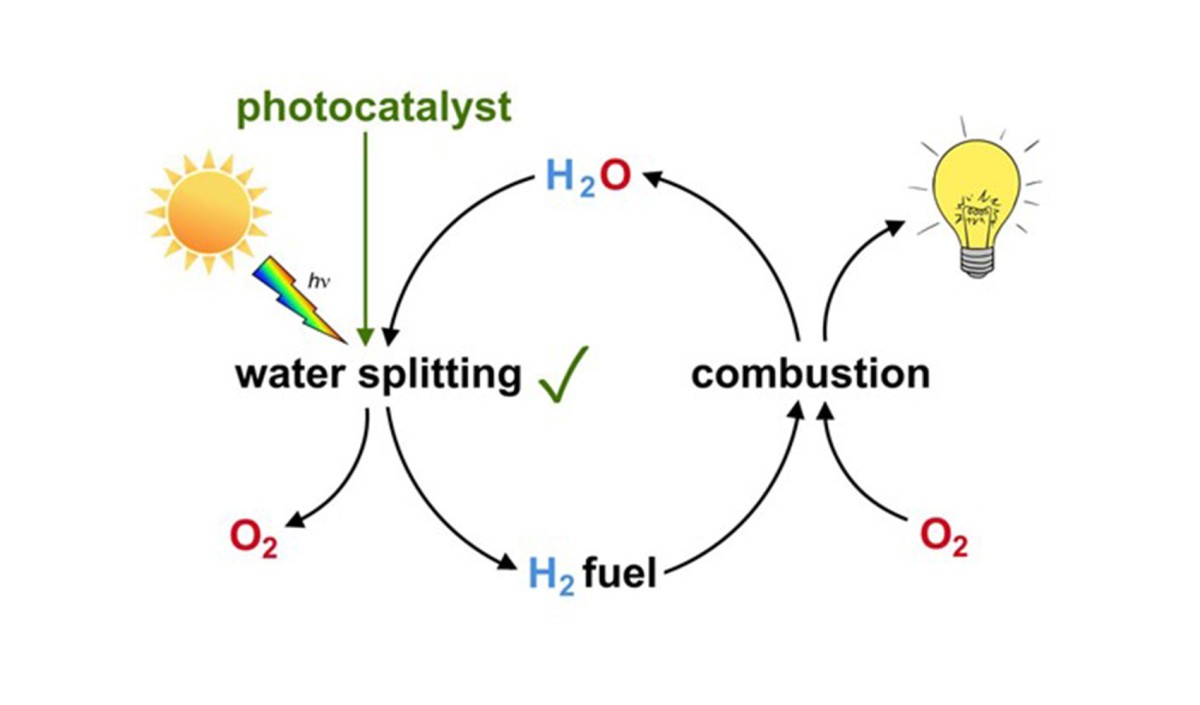
Schematische Darstellung der fotokatalytischen Wasserspaltung (water splitting) mit anschließender Verbrennung (combustion) des Wasserstoffs zur Energiegewinnung als CO2-freier Kreislaufprozess
© Pablo Ayala, IMC – TU Wien
Der Vorteil gegenüber direkter Stromgewinnung mit Fotovoltaik besteht vor allem darin, dass Wasserstoff beliebig gespeichert und transportiert werden kann. Es gibt also nicht nur Strom, wenn die Sonne scheint. Bei der Verbrennung von Wasserstoff entsteht Wasser und nicht etwa Kohlendioxid wie bei der Verbrennung fossiler Brennstoffe (Gas, Kohle, Holz). Man spricht auch von einem CO2-freien Kreislauf. Andere Forschungsgruppen befassen sich mit dem Abbau von toxischen Molekülen in Abluft oder Abwasser, zum Beispiel Kohlenmonoxid- und Stickoxidabbau im Abgaskatalysator oder Abbau von Pestiziden in landwirtschaftlichen Anlagen. Oder mit biokompatiblen Anwendungen: Mithilfe von Katalysatoren können medizinische Implantate hergestellt werden, die biokompatibel und damit im menschlichen Körper gut verträglich sind.
Die Katalyse, die wir im Lauf des vergangenen Jahrhunderts in lebenden Systemen entdeckt haben, findet heute – von der Reinigung von Verkehrs- und Industrieabgasen über die Herstellung von Medikamenten und Nahrungsmittel – in fast allen Bereichen unseres Lebens Anwendung.
Sie macht unseren Alltag nachhaltiger und einfacher, in manchen Fällen gar erst möglich.
Leseliste:
- Behr, A., Agar, D.W., Jörissen, J., Vorholt, A.J. (2016). Heterogene Katalyse. In: Einführung in die Technische Chemie. Springer Spektrum, Berlin, Heidelberg. https://doi.org/10.1007/978-3-662-52856-3_12
- Das wissenschaftliche Journal Nature Catalysis befasst sich ausschließlich mit neuen und spannenden Entwicklungen in der Forschung an Katalysatoren: https://www.nature.com/natcatal/
Jakob Rath (29) ist Chemiker und wissenschaftlicher Mitarbeiter an der Technischen Universität Wien. Er beschäftigt sich mit neuen Synthesewegen für Nanomaterialien und mit deren Charakterisierung und Anwendung als Katalysatoren. In seiner Freizeit setzt er sich für Themen zur Kulturförderung und zur Schaffung neuer Grünflächen in der Stadt ein.